高成功率PCR酵素
KOD FX
TOYOBO
価格表
用途
● PCR
説明
 本製品は、KOD DNA polymeraseをベースに開発された高性能PCR試薬です。優れた「増幅成功率」、「伸長性」、「増幅効率」を示し、幅広いPCRにおいて確実な結果が期待できます。PCR成功率が高く、あらゆる実験における検討に適したPCR酵素です。
本製品は、KOD DNA polymeraseをベースに開発された高性能PCR試薬です。優れた「増幅成功率」、「伸長性」、「増幅効率」を示し、幅広いPCRにおいて確実な結果が期待できます。PCR成功率が高く、あらゆる実験における検討に適したPCR酵素です。
KOD FXのPCRエラーによるミス塩基の取り込み頻度(エラー率)は、実際にシーケンシングにて解析した結果、144,535塩基中、わずか19塩基でした(Taq DNA polymeraseの約11倍の正確性)。よって、正確性はKOD -Plus-やKOD -Plus-Ver.2より若干下がりますが、クローニングにも充分応用可能です。この酵素で増幅されたDNA断片の末端のほとんどは、平滑化されています。
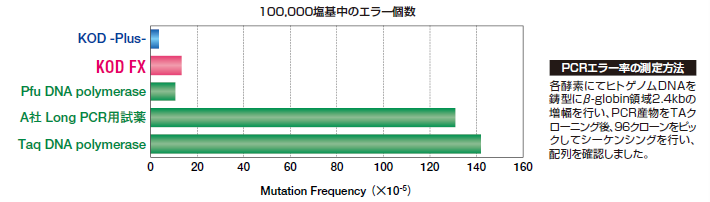
特長
●高い増幅成功率
GC-richターゲットや細胞懸濁液・マウステール/植物ライセート・全血・カビ・酵母などのクルードサンプルなどからも高い成功率で増幅が可能です。
●抜群の増幅効率
高い収量が得られるため、少ない鋳型量からでも増幅が可能です。
●優れた伸長性
λDNAから40kb、humanゲノムDNAから24kb、cDNAから13.5kbの増幅が可能であることを確かめています。
●ホットスタートでPCRパフォーマンス向上
2種類の抗KOD抗体を酵素に混合することによって、非特異反応の原因となる常温下でのPolymerase活性と3'→5'Exonuclease活性を抑制しています。抗体はPCRの最初の変性ステップで失活し、増幅反応には影響を及ぼしません。
実施例
1.アルカリ溶解法で調製したマウステールライセートからの増幅
アルカリ溶解法(右の基本反応条件ご参照)で調製したマウステールライセート0.5μLを直接PCR反応液に添加して、Mouse membrane glycoprotein(Thy-1)gene(M10246)をターゲットとして、2ステップサイクルを用いて、30サイクルの増幅を行いました。
その結果、KOD FXを用いた場合のみ、明瞭な増幅が認められました。アルカリ溶解法は、Proteinase Kを用いる方法よりも手間が少ないため、より簡便にトランスジェニックマウスの遺伝子解析ができるものと思われます。
また、増幅産物を精製なしで、数種類の制限酵素で消化する検討もあわせて行い、下記制限酵素により完全に切断を受けることを確認しました。(詳細はこちら)
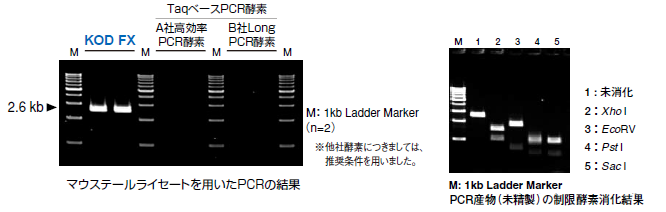
2. ワンステップ法で調製した植物ライセートからの増幅
ワンステップ法(右の基本反応条件ご参照)で調製したトマト、タバコ、イネの葉、及び精米のライセート1μLを直接PCR反応液に添加して、rbcLをターゲットとして、2ステップサイクルを用いて、30サイクルの増幅を行いました。その結果、KOD FXを用いたときのみ明瞭な増幅が認められました。
また、タバコ葉で2.2, 4.6kbをターゲットにPCRを行ったところ、どちらも明確な増幅が見られました。
ワンステップ法とKOD FXを組み合わせることで、植物の遺伝子解析を簡便化できると思われます。
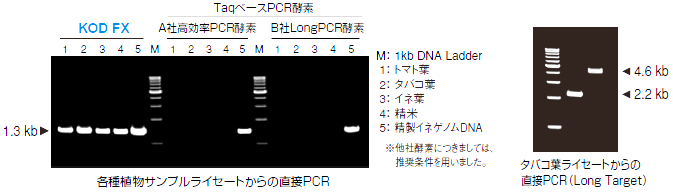
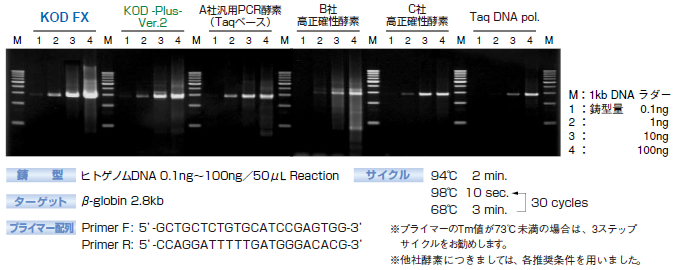
3.鋳型DNA量の検討
KOD FXと他社PCR酵素を用いて、鋳型DNA量と増幅効率の比較を行いました。
増幅反応は、0.1ng~100ngまでのゲノムDNAを鋳型に、human β-globin 2.8kbをターゲットとして、50μLの反応系で、プライマー15pmoles、KOD FX 1Uを用いて、2ステップサイクルにて30サイクルの増幅を行いました。
その結果、KOD FXでは、他社PCR酵素に比べて明らかに増幅効率が高い結果を得ることができました。
増幅困難なケースの成功例
<GCリッチターゲット・プライマー配列>
実施例7: プライマー設計に制限がある場合(MAPK1)の増幅
実施例8: GCリッチターゲット(TGFβ, IGF2R)の増幅
実施例16:BMP-2遺伝子の増幅
実施例18:Human転写因子(HNF3b, C/EBPβ, FTFおよび HNF6)cDNAとmiR-17,18,19,20,92領域genomic DNAの増幅
実施例21:ヒトSF-1cDNA(GCリッチ)の増幅
実施例23: 新規イネOsSRS3遺伝子の5´領域の単離
<長鎖ターゲット>
実施例4: Long PCRにおけるPrimerの精製グレード及び鎖長の影響
実施例6: 真核細胞最長DMD遺伝子(13.5Kb)のPCRクローニング
実施例19:植物発現プロモーターに連結させた植物ウイルスcDNA増幅
<PCR阻害物質含有サンプル>
実施例24: ヒト糞便から精製したDNAを用いたHelicobacter pylori cagA遺伝子の増幅
実施例34: 淡水産シオグサ属藻類(緑藻)のDNA断片増幅
<その他>
実施例14:マウスゲノムDNAを用いたPGK neo遺伝子の検出
実施例15:Chick GAD67プロモーター領域のクローン化
実施例17:c-mos遺伝子の増幅(変異導入のためのPCR)
実施例20:ヒトCYP11A1遺伝子のプロモーター領域の増幅
実施例27: 緑膿菌DNAの遺伝子増幅
クルードサンプルからの増幅例
<血液>
実施例9: 血液(Whole Blood)サンプルからの増幅
実施例25: トランスジェニックラット血液(ろ紙血)からのGFP遺伝子の検出
実施例33: マウス濾紙血によるPCR解析
<マウステール>
実施例11: マウステール溶解液を直接用いたトランスジェニックマウスのジェノタイピング
実施例12: トランスジェニックマウステールからのジェノタイピング
実施例28: マウス尾溶解液からのゲノムDNAの増幅
<組織・細胞>
実施例10: 培養細胞懸濁液からの増幅
実施例13: ヒト毛根サンプルからの簡便なPCR増幅
実施例31: ホルマリン固定パラフィン包埋切片から抽出したDNAの解析
実施例37: ヒト爪からの直接PCR
<細菌・真菌>
実施例22: コロニーPCRによる酵母形質転換体の確認
実施例29: 病原酵母Cryptococcus neoformans菌体(コロニー)からのダイレクトPCR
実施例30: カビ(Aspergillus oryzae)からのダイレクトPCR
実施例35: 麹菌Aspergillus oryzaeの遺伝子破壊の確認
実施例36: コロニーPCRによる各種細菌DNAの検出
<植物>
実施例26: DGGE法を用いた沿岸海域に生息する植物プランクトン(クリプト藻)の多様性の解析
実施例38: タバコ葉からの直接PCR
実施例39: 植物葉からの迅速DNA増幅
<昆虫>
実施例32: キイロショウジョウバエの羽からの簡便なロングPCR法
<魚類>
実施例40: メダカ幼魚の遺伝子による性別判断方法
その他の実施例
実施例5: Template別増幅可能長
実施例41: 微量DNAからのPacBio社 SMRTbell® ライブラリー調製
参考文献
1) K. Wakahara et al., Mol Cancer Res 6: 1937-1945.(2008)
2) N. Yamada et al., Mol Vis., 15::974-979.(2009)
- 製品内容
KOD FX DNA Polymerase (1U/μL) 200μL×1本
2×PCR Buffer*[KFX-1B] 1.7mL×3本
2mM dNTPs[NTP-201] 1mL×2本
* 終濃度2.0mMのMg2+を含有します。
※50μLで反応を行なった場合、200回用としてご使用になれます。
形状:
50mM Tris-HCl(pH8.0)
0.1mM EDTA
1mM DTT
0.001% Tween® 20
0.001% Nonidet® P-40
50% Glycerol
活性の定義:
75℃において、30分間に10nmolの全ヌクレオチドを酸不溶性画分に取り込む酵素量を1Uとします。
起源:
E.coli 組換体
- 注意事項
PCRには製品に添付されているdNTPsまたは別売りのdNTPs Mixture (2mM) [NTP-201]をご使用ください。他のdNTPsでは、十分な性能が得られない場合があります。
- 基本反応条件
-
反応液組成
滅菌蒸留水XμL
2x PCR Buffer for KOD FX 25μL
2mM dNTPs 10μL(0.4mM)
各Primer 15pmol each
鋳型 1~50ng(Plasmid)
10~200ng(Genome DNA)
~200ng[RNA相当](cDNA)
~2μL(クルードサンプル)
〈ワンステップ法の植物ライセートは1μL〉
KOD FX (1U/μL) 1μL(1U)
Total Volume 50μL
〈2ステップサイクル〉*
94℃ 2min.
↓
98℃ 10sec.
68℃ 1min./kb 25~40 cycles
〈3ステップサイクル〉*
94℃ 2min.
↓
98℃ 10sec.
(Tm-5)℃ 30sec.
68℃ 1min./kb 25~40 cycles
〈ステップダウンサイクル〉*
94℃, 2min.
↓
98℃, 10sec.
74℃, 1min./kb 5 cycles
↓
98℃, 10sec.
72℃, 1min./kb 5 cycles
↓
98℃, 10sec.
70℃, 1min./kb 5 cycles
↓
98℃, 10sec.
68℃, 1min./kb 15~25 cycles
↓
68℃, 7min.
*2ステップサイクルを基本としています。プライマーのTm値が68℃未満または2ステップサイクルで増幅が見られない場合は、3ステップサイクルをお試しください。また、10kb以上のターゲットを増幅するLong PCRやエキストラバンドあるいはスメアが見られた場合には、ステップダウンサイクルをお試しください。
※プライマーのTm値の計算は、最近接塩基対法(Nearest Neighbor method)を用いております。プライマーのTm値計算表(EXCEL)は、こちらからダウンロードいただけます。
<アルカリ溶解法>
1) マウステール(約3mm)をマイクロチューブへ入れる。
2) 50mM NaOHを180μL添加。
3) Vortexにてよく攪拌。
4) 95℃・10min.
5) Tris-HCl(pH8.0)を20μl添加。
6) Vortexにてよく攪拌。
7) 遠心(12,000rpm, 10min.)
8) 上清0.5~2μLをPCR反応液に添加。
(マウステールは完全には溶解しません)
<ワンステップ法>
1) 葉(3mm角)または精米(1粒)をマイクロチューブへ入れる。
2) Buffer A*を100μL添加。
3) Vortexにてよく攪拌。
4) 95℃・10min.
5) Vortexにてよく攪拌。
6) 遠心(12,000rpm, 10min.)
7) 上清1μLをPCR反応液に添加。
(植物組織は完全には溶解しません)
*Buffer A:
100mM Tris-HC(l pH9.5)
1M KCl
10mM EDTA
- ワンポイントアドバイス
KOD FX 実施例集
KOD FX 実施例集2
●PCR産物のクローニング
本酵素のPCR産物は平滑化されているため、平滑末端クローニング法によってクローニングできます。
その際、ベクター側を脱リン酸化処理している場合、リン酸化を行ったPCR産物を用いるか、リン酸化プライマーを用いて増幅したPCR産物を用いる必要があります。
また、本酵素のPCR産物は平滑化されているため、そのままではTAクローニングすることはできません。
専用の高効率TAクローニングキット「TArget CloneTM -Plus-」を用いると簡便・高効率にTAクローニングが可能です。
●プライマーについて
10kbを超えるターゲットを増幅する場合には、カートリッジ精製以上のグレードで、27mer以上のプライマーの使用をお勧めします。
また、3'側にミスマッチのあるプライマーは、本酵素によって校正を受ける場合があります。
※プライマーのTm値の計算は、最近接塩基対法(Nearest Neighbor method)を用いております。プライマーのTm値計算表(EXCEL)は、こちらからダウンロードできます。イノシンを含むプライマーのTm値はこの方法では計算できません。
●DNA末端平滑化に用いる場合はこちらをご覧ください。
FAQはこちら →
トラブルシューティングは
←こちら
English Page
- ※ 法規制について
- 毒: 毒物及び劇物取締法[医薬用外毒物]
- 国: 国民保護法[毒素]
- 劇: 毒物及び劇物取締法[医薬用外劇物]
- 組: カルタヘナ法(遺伝子組換え生物等の使用等の規制による
- 危: 消防法[危険物]
- 生物の多様性の確保に関する法律)
- P: PRTR法(化学物質排出把握管理促進法)[届け出義務物質]
- 申: ご購入時に申込書の提出が必要な製品
- 労: 労働安全衛生法[通知または表示義務物質]
- なし: 上記法令や申込書の提出に該当しない製品







