T4ファージ由来DNA連結酵素
T4 DNA Ligase
TOYOBO
価格表
用途
●DNA断片やニックの連結
目的遺伝子のベクターへの挿入や、DNAへのリンカー付加などの反応に用いることができます。
説明
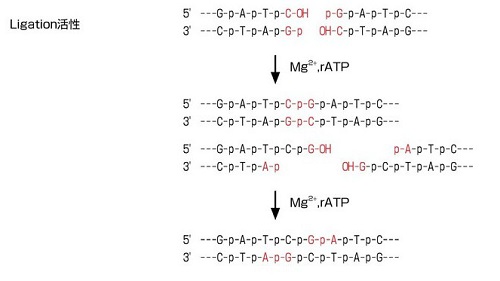
T4 DNA Ligaseは、隣接したDNAの5'端のリン酸基と3'端の水酸基をホスホジエステル結合によって連結する酵素で、Mg2+とrATPを要求します。
平滑末端及び突出末端の2本鎖DNA、またはニックの入った2本鎖DNAに作用しますが、RNAとRNAや、RNAとDNAにはほとんど作用しません。
また、ライゲーション反応の速度は、DNA末端の形状及び塩基配列によって異なります。
特長
実施例
DNA末端形状による反応性の比較
-
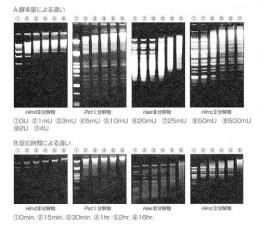
さまざまな制限酵素により切断したDNA断片を用いDNAの末端形状によるT4 DNA Ligaseの反応性の違いを検討しました。
5'末端濃度を0.1μMとし、さまざまな酵素量で16℃で1hr.反応させた後、電気泳動解析した結果をAに示しました。また同様に、5'末端濃度を0.1μM(HaeⅢは1.0μM)とし、16℃でさまざまな時間反応させた後、電気泳動解析した結果をBに示しました。
結果より、平滑末端のDNAは、突出末端のDNAに比べて、ライゲーション効率が低いことが分かります。T4 DNA Ligaseの平滑末端DNAに対するKm値は突出末端の場合に比べ約100倍高いため、平滑末端DNAのLigation反応では、DNAの濃度とLigaseの酵素量を高く設定する必要があります。
参考文献
1)N. E. Murray et al., J. Mol. Biol.,132: 493(1979)
2)B. Weiss et al., J. Biol. Chem.,243: 4543(1968)
- 製品内容
T4 DNA Ligase(1-5U/μL)
10×Buffer* [LGA-1B]
*rATPは含まれません。rATP[Code No.ATP-111]を用いることができます。
形状:
20mM Tris-HCl (pH7.6)
1mM EDTA
60mM KCl
5mM DTT
50% Glycerol
10×Buffer [Code No. LGA-1B] 組成:
660mM Tris-HCl (pH7.6)
100mM DTT
66mM MgCl2
活性の定義:
ATP-PPi交換反応において37℃,pH7.6で20分に1nmoleの32PPiを交換する酵素量を1Uとします。
本酵素1U(Weiss Unit)は、125Ligation Unitに相当します。
起源:
E.coli 組換体
純度:
本酵素12.5Uと1μgのλDNA/HindⅢ分解物とを、50μL反応系にて16℃で16時間反応させてもDNAの電気泳動パターンは変化しません。
本酵素と1μgのE.coli [3H]-DNAを16℃で反応させた場合、酸可溶性画分に遊離される放射活性は1時間に1U当たり0.01%以下です。
本酵素と1μgの5‘端に32PをラベルしたλDNA/HindⅢ分解物を16℃で反応させた場合、酸可溶性画分に遊離される放射活性は1時間に1U当たり0.01%以下です。
本酵素12.5Uと1μgのsuper coiled φx174 DNA とを、50μL反応系にて16℃で16時間反応させてもDNAの電気泳動パターンは変化しません。
- 基本反応条件
-
<ベクターへのライゲーション>
滅菌蒸留水 XμL
ベクターDNA 0.05-0.5μg
インサートDNA ベクターの3倍のmole数
10×Buffer 2μL
rATP 1mM
T4 DNA Ligase 0.5-1U(突出末端)
1-5U(平滑末端)
Total Volume 20μL
16℃、4-16hr.
<リンカーライゲーション>
滅菌蒸留水 XμL
DNA 0.1-1μg
リンカー DNAの10倍のmole数
10×Buffer 2μL
rATP 1mM
T4 DNA Ligase 1-5U
Total Volume 20μL
16℃、8-16hr.
*DNAの濃度や形状、塩基配列、長さによって効率は変化します。
- ワンポイントアドバイス
-
●平滑末端のライゲーション
平滑末端のライゲーションは、突出末端に比べて反応性が低い傾向にあります(Km値は、突出末端の約100倍)。平滑末端によるライゲーションを行う場合は、DNA濃度を高くし、使用する酵素量を突出末端の2~5倍程度多く添加します。
●反応温度について
本酵素の至適温度は37℃ですが、連結するDNAの末端のハイブリダイゼーションの効率を考えて通常反応は16℃で行います。場合により、4℃~室温で反応することも可能です。
●EDTAについて
本酵素はMg2+を要求するため、Mg2+をキレートするEDTAは反応を阻害する場合があります。高濃度のEDTAを含むバッファーにDNAを溶解させたサンプルとして使用する場合には、滅菌蒸留水かTEバッファーに置換した後、使用することをお勧めします。
●DNA量について
プラスミドDNAとインサートDNAの反応は、モル比で1:3になるようにします。コスミドやファージへのライゲーションの場合は、ベクターとインサートのモル比は1:1になるようにして、DNA濃度も高く設定します(0.05~0.1μg/μL以上)。
- ※ 法規制について
- 毒: 毒物及び劇物取締法[医薬用外毒物]
- 国: 国民保護法[毒素]
- 劇: 毒物及び劇物取締法[医薬用外劇物]
- 組: カルタヘナ法(遺伝子組換え生物等の使用等の規制による
- 危: 消防法[危険物]
- 生物の多様性の確保に関する法律)
- P: PRTR法(化学物質排出把握管理促進法)[届け出義務物質]
- 申: ご購入時に申込書の提出が必要な製品
- 労: 労働安全衛生法[通知または表示義務物質]
- なし: 上記法令や申込書の提出に該当しない製品







