高正確・高効率・高速PCR酵素
KOD -Plus- Neo
TOYOBO
価格表
用途
● PCR
説明
 KOD -Plus- Neoは、高正確性PCR酵素KOD -Plus-シリーズの技術に新たに開発した「伸長エンハンサー」を応用することで、高い正確性(Taq DNA polymeraseの約80倍)を保持しつつ、微量な鋳型DNAからの増幅や長いターゲットの増幅効率を格段に向上させた酵素です。
KOD -Plus- Neoは、高正確性PCR酵素KOD -Plus-シリーズの技術に新たに開発した「伸長エンハンサー」を応用することで、高い正確性(Taq DNA polymeraseの約80倍)を保持しつつ、微量な鋳型DNAからの増幅や長いターゲットの増幅効率を格段に向上させた酵素です。
特長
●微量な鋳型DNAから正確・高効率な増幅が可能
.jpg) 伸長エンハンサー技術を応用することによって、微量な鋳型DNAからでも高正確・高効率に目的遺伝子を増幅することができるようになりました。本酵素は高い正確性(Taqの約80倍)を示し、低コピー数の鋳型からも正確に目的遺伝子を増幅することができます。
伸長エンハンサー技術を応用することによって、微量な鋳型DNAからでも高正確・高効率に目的遺伝子を増幅することができるようになりました。本酵素は高い正確性(Taqの約80倍)を示し、低コピー数の鋳型からも正確に目的遺伝子を増幅することができます。
* PCRエラー率は、各酵素にてヒトゲノムDNAを鋳型にβ-globin遺伝子(2.4kb)の増幅を行い、PCR産物をTAクローニング後、96クローンをシーケンシング解析し、測定しました。
●ホットスタートでPCRパフォーマンス向上
2種類の抗KOD抗体を酵素に混合することによって、非特異反応の原因となる常温下でのPolymerase活性と3'→5'Exonuclease活性を抑制しています。抗体はPCRの最初の変性ステップで失活し、増幅反応には影響を及ぼしません。
●伸長時間を短縮<30sec./kb>(長いターゲットでより便利になりました)
伸長時間を、従来品の60sec./kbから30sec./kbに短縮。長いターゲットでより便利になりました。
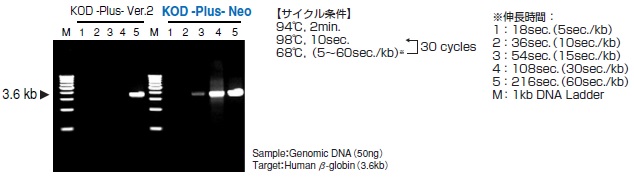
●長鎖ターゲットの増幅
従来品より伸長性が向上し、さまざまな長さのターゲットを増幅できます。ゲノムDNAで24kbまでの増幅を確認しています。
●さまざまなプライマーで同一温度サイクル条件を実現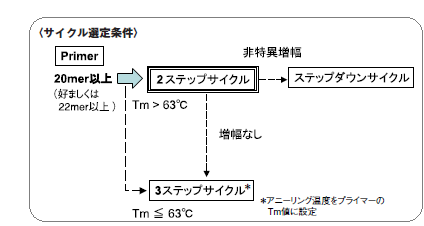
20mer以上のプライマー(Tm値>63℃)においては、まずは2ステップサイクルをお試しください。サイクル条件の検討は不要です。(基本反応条件ご参照)
*Tm値は、最近接塩基対法(Nearest Neighbor Method)を用いて計算した値を利用しています。
原理
KOD DNA polymeraseは、強い3‘→5’エキソヌクレアーゼ活性(校正活性)を有し、正確にターゲット配列を増幅することができるため、クローニング用のPCR酵素として好評いただいております。
しかし、高正確性PCR酵素は、20~30サイクル以降、増幅が持続しなくなる<プラトー現象>が出やすいと言われています。
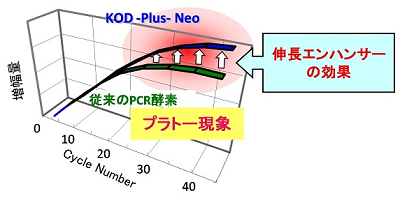
KOD –Plus-Neoは、高正確性PCR酵素KOD -Plus-シリーズの技術に、弊社で新たに開発した「伸長エンハンサー」を応用することでTaqの約80倍というKOD -Plus-シリーズの高い正確性を保持しつつ、<プラトー現象>を抑えることにより、微量な鋳型DNAからの増幅や長いターゲットの増幅効率を格段に向上させることに成功しました。
実施例
1.Total RNA からの全長ORFの増幅
HeLa cell由来Total RNA 1μgから合成したcDNA約50ngを使用して、さまざまなプロテインキナーゼのORF(open reading frame)の全長を増幅しました。
サイクルは各酵素の最適条件にて、30サイクル行いました。
その結果、KOD -Plus- Neoで増幅した場合にのみ、すべての遺伝子で明瞭な増幅産物を得ることができ、すべてのORFを迅速にクローニングすることが可能でした。

2. β-globin遺伝子上の各領域における増幅効率・伸長性の比較
Human genomic DNA 50ngを用いてさまざまなサイズのβ-globin遺伝子の増幅を行いました。反応はそれぞれのPCR酵素の推奨条件に従って、同じサイクル数にて実施しました。
その結果、KOD -Plus- Neoを用いた場合でのみ、17.5kbまでの明瞭な増幅を確認することができました。また、17.5kb以下の増幅においても、他社PCR酵素を大幅に上回る収量が認められました。
.jpg)
3. 長鎖ターゲットの増幅
ヒトゲノムDNA(200 ng)をテンプレートにさまざまなプライマー濃度でβ-globin遺伝子(17.5 kb)、tPA(Human tissue-type plasminogen activator)遺伝子(24.0 kb)の増幅を行いました。その結果、長鎖ターゲットの増幅では、プライマー濃度を下げることで増幅量が増すことが示されました。
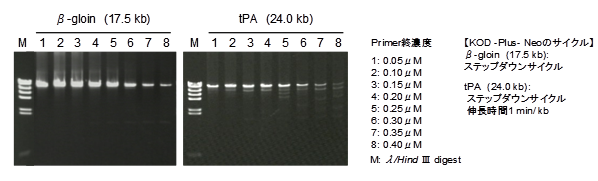
このように10 kb以上の長鎖ターゲットを増幅する場合は、プライマー濃度を0.15μM(終濃度)でご利用ください。増幅量が向上する場合があります。
参考文献
1) M. Takagi et al., Appl. Environ. Microbiol., 63 : 4504-4510 (1997)
2) H. Hashimoto et al., J. Biochem.(Tokyo), 125 : 983-986 (1999)
3) H. Mizuguchi et al., J. Biochem.(Tokyo), 126 : 762-768 (1999)
4) M. Nishioka et al., J. Biotechnol., 88 : 141-149 (2001)
5) H. Hashimoto et al., J. Mol. Biol., 306 : 469-77 (2001)
6) T. Imanaka et al., J. Chin. Inst.Chem. Engrs., 32 : 277-288 (2001)
- 製品内容
KOD -Plus- Neo (1U/μL) 200μL×1本
10×PCR Buffer for KOD -Plus- Neo [KOD-4B] 1mL×1本
25mM MgSO4 [KOD-2S] 1mL×1本
2mM dNTPs [NTP-201] 1mL×1本
※50μLで反応を行なった場合、200回用としてご使用になれます。
形状:
50mM Tris-HCl (pH8.0)
25mM KCl
0.1mM EDTA
1mM DTT
0.05% Tween® -20
0.05% Nonidet® P-40
50% Glycerol
活性の定義:
75℃活性測定条件で30分間に10nmolの全ヌクレオチドを酸不溶性画分に取り込む酵素量を1Uとします。
純度
本酵素15UとpBR322 1μgを75℃で4時間反応させても電気泳動パターンは変化しないことを確認しています。
起源:
E.coli 組換体
- 注意事項
PCRには製品に添付されているdNTPsまたは別売りのdNTPs Mixture (2mM) [NTP-201]をご使用ください。他のdNTPsでは、十分な性能が得られない場合があります。
- 基本反応条件
-
滅菌蒸留水 X μL
10×PCR Buffer for KOD -Plus- Neo 5μL
2mM dNTPs 5μL
25mM MgSO4 3μL
10pmol/μl Primer F 1.5μL
10pmol/μl Primer R 1.5μL
KOD -Plus- Neo (1.0U/μl) 1μL
Genomic DNA ~200ng
Plasmid DNA ~50ng
cDNA ~200ng (RNA相当)
Total 50μL
〈2ステップサイクル〉*
94℃ 2min.
↓
98℃ 10sec.
68℃ 30sec./kb 25~45 cycles
〈3ステップサイクル〉*
94℃ 2min.
↓
98℃ 10sec.
Tm℃ 30sec.
68℃ 30sec./kb 25~45 cycles
〈ステップダウンサイクル〉*
94℃, 2min.
↓
98℃, 10sec.
74℃, 30sec./kb 5 cycles
↓
98℃, 10sec.
72℃, 30sec./kb 5 cycles
↓
98℃, 10sec.
70℃, 30sec./kb 5 cycles
↓
98℃, 10sec.
68℃, 30sec./kb 15~30 cycles
↓
68℃, 7min.
*プライマーのTm値が63℃より高い場合は、2ステップサイクルで行います。
Tm値が63℃以下および2ステップで増幅が見られない場合は、3ステップサイクルをお試しください。
増幅産物にエキストラバンドやスメアが見られた場合は、ステップダウンサイクルをお試しください。
※プライマーのTm値の計算は、最近接塩基対法(Nearest Neighbor method)を用いております。プライマーのTm値計算表(EXCEL)は、こちらからダウンロードいただけます。
- ワンポイントアドバイス
●PCR産物のクローニング
本酵素のPCR産物は平滑化されており、平滑末端クローニング法によってクローニングできます。
その際ベクター側を脱リン酸化処理している場合、PCR産物のリン酸化を行うか、5'リン酸基のついたプライマーを使用する必要があります。
また、本酵素のPCR産物は平滑化されているため、直接TAクローニングすることはできません。
専用のTAクローニングキット「TArget CloneTM-Plus-」をご使用ください。
●PCR条件の設定について
酵素の標準使用量は、50μLの系に対して1Uとしてください。
伸長反応は、68℃で行い、ターゲット1kbに対して1min.を標準とします。スメアリングが起こっている場合はMgSO4の濃度を下げ、増幅が見られない場合はMgSO4濃度を上げて検討します。
●GCリッチな鋳型の場合
反応液にDMSOを最終濃度2〜5%程度添加することにより、改善される場合があります。
●RT反応液を鋳型とする場合
RT反応液の大量の持ち込みは、本酵素によるPCR反応を阻害する場合があります。
RT反応液のPCRへの持ち込みは、PCR反応液の1/25以下(好ましくは1/50以下)をお薦めします。
この場合、RT反応液からのMg2+やdNTPsの持ち込みについては考慮する必要はなく、基本反応条件に沿って、本酵素の添付のdNTPsとMgSO4を添加していただければ問題ありません。
●プライマーの設計
3'側にミスマッチのあるプライマーは、本酵素によって校正を受ける場合があります。
※プライマーのTm値の計算は、最近接塩基対法(Nearest Neighbor method)を用いております。プライマーのTm値計算表(EXCEL)は、こちらからダウンロードできます。イノシンを含むプライマーのTm値はこの方法では計算できません。
●DNA末端平滑化に用いる場合はこちらをご覧ください。
FAQはこちら →
トラブルシューティングは
←こちら
English Page
- ※ 法規制について
- 毒: 毒物及び劇物取締法[医薬用外毒物]
- 国: 国民保護法[毒素]
- 劇: 毒物及び劇物取締法[医薬用外劇物]
- 組: カルタヘナ法(遺伝子組換え生物等の使用等の規制による
- 危: 消防法[危険物]
- 生物の多様性の確保に関する法律)
- P: PRTR法(化学物質排出把握管理促進法)[届け出義務物質]
- 申: ご購入時に申込書の提出が必要な製品
- 労: 労働安全衛生法[通知または表示義務物質]
- なし: 上記法令や申込書の提出に該当しない製品







