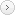実施例
SuperPrep 実施例4 浮遊細胞の96ウェルプレートアッセイおよび遺伝子発現解析の事例
 96ウェルプレートを用いるハイスループット遺伝子発現解析には多くは接着細胞が使用されますが、アッセイによっては浮遊細胞を対象としなければいけないケースもあります。しかし、浮遊細胞を96ウェルプレートでアッセイする場合、細胞のロスにより、精度が低くなるおそれがあります。そこで、今回、SuperPrep® Cell Lysis & RT Kit for qPCRによるヒト単球由来浮遊系細胞株U937の細胞ライセート調製手技について検討を行いましたのでご紹介いたします。
96ウェルプレートを用いるハイスループット遺伝子発現解析には多くは接着細胞が使用されますが、アッセイによっては浮遊細胞を対象としなければいけないケースもあります。しかし、浮遊細胞を96ウェルプレートでアッセイする場合、細胞のロスにより、精度が低くなるおそれがあります。そこで、今回、SuperPrep® Cell Lysis & RT Kit for qPCRによるヒト単球由来浮遊系細胞株U937の細胞ライセート調製手技について検討を行いましたのでご紹介いたします。
【方法】
(1)プレートアッセイにおける細胞洗浄方法の検討
- U937細胞を10%FBSを添加したRPMI 1640培地で希釈し、96ウェルプレートに、1×101、1×102、1×103、1×104、1×105cells/ウェルとなるよう、100μLずつ各3ウェルに播種したプレートを3枚用意しました。
- プレート遠心機で2,000rpm、5分間遠心し、それぞれ以下の3通りの方法で上清を除去しました。
①マルチチャンネルピペットの先を内側の壁底にあてて上清を除去(ピペット除去)
②プレートを下向きに傾けて上清を除去(デカンテーション)
 ③デカンテーションで上清を除去し、ペーパータオル上でプレートを下向きにたたき、完全に上清を除去(デカンテーション&タッピング)
③デカンテーションで上清を除去し、ペーパータオル上でプレートを下向きにたたき、完全に上清を除去(デカンテーション&タッピング) - PBS(-)を100μL各ウェルに加え、プレート遠心機で2,000rpm、5分間遠心し、再び前記3種類の方法〈①②③〉で上清を除去しました。(PBS(-)を添加後、細胞をほぐす操作は省略しました)。
- SuperPrep® Cell Lysis & RT Kit for qPCR [Code No.SCQ-101]の標準プロトコールでcDNA合成を行いました。
- 上記で合成したcDNAを使って、THUNDERBIRD® Probe qPCR Mix [Code No.QPS-101] を用いてβ-actin遺伝子のTaqMan®アッセイによる測定を実施しました。
(2)浮遊細胞の96ウェルプレートアッセイ
- U937細胞を5×105 cells/mLになるように10% FBSを添加したRPMI1640培地に懸濁し、96ウェルプレートに2mLずつ播種したのち、最終濃度0、 0.01、0.1、1、10μMになるようにPhorbol 12-myristate 13-acetate (PMA)を加え、37℃、CO2インキュベーターで6時間インキュベートしました。
- この細胞を96ウェルプレートに100μLずつ各3ウェルに分注しました(5×104cells/ウェル)。
- このプレートをプレート遠心機で2,000 rpm、5分間遠心し、マルチチャンネルピペットで上清を除去しました。
- PBS(-)を100μL各ウェルに加え、プレート遠心機で2,000rpm、5分間遠心し、同様に上清を除去しました(PBS(-)を添加後、細胞をほぐすような操作は省略しました)。
- SuperPrep® Cell Lysis & RT Kit for qPCR [Code No.SCQ-101] の標準プロトコールでcDNA合成を行いました。
- 上記で合成したcDNAを使って、THUNDERBIRD® Probe qPCR Mix [Code No.QPS-101] を用いてβ-actin、IL-8、TNF遺伝子のTaqMan®アッセイによる測定を実施しました。
【結果】
(1)プレートアッセイにおける細胞洗浄方法の検討
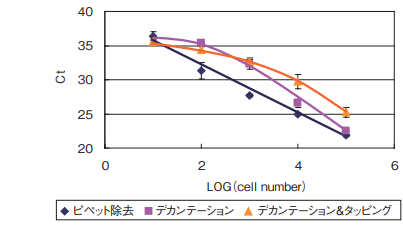 細胞洗浄のための上清除去の方法として、8連チャンネルピペットの先を内側の壁底につけるような形で静かに上清を除去した場合、細胞量とβ-actin遺伝子のCt値に高い直線性が認められました。一方、デカンテーションではピペットで除去した場合に比べ、Ct値の後退が認められ、細胞をロスしていると考えられます。
細胞洗浄のための上清除去の方法として、8連チャンネルピペットの先を内側の壁底につけるような形で静かに上清を除去した場合、細胞量とβ-actin遺伝子のCt値に高い直線性が認められました。一方、デカンテーションではピペットで除去した場合に比べ、Ct値の後退が認められ、細胞をロスしていると考えられます。
少し手間はかかりますが、ピペットで上清を除いていただくことで、精度の高いアッセイを行っていただけます。また、この作業はアスピレーターを用いる除去法も同様に使用可能であることを確かめています。
(2)浮遊細胞の96ウェルプレートアッセイ
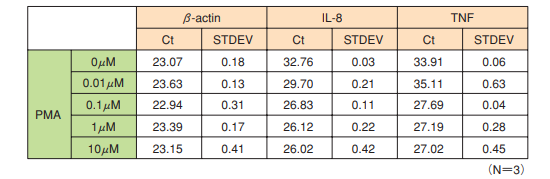
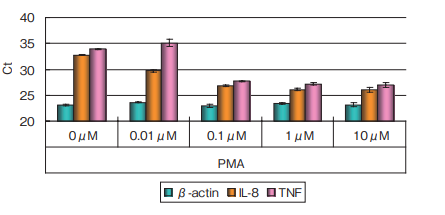 PMAで刺激したU937細胞を処理して、リアルタイムPCRを実施しました。この結果、インターナルコントロールとしたβ-actin遺伝子については、同一条件内、条件間でCt値の変動やバラツキはほとんどなく、一定に維持されていました。一方、ターゲット遺伝子としたIL-8、TNFについては、 PMA濃度依存的な発現量の亢進を確認することができました。
PMAで刺激したU937細胞を処理して、リアルタイムPCRを実施しました。この結果、インターナルコントロールとしたβ-actin遺伝子については、同一条件内、条件間でCt値の変動やバラツキはほとんどなく、一定に維持されていました。一方、ターゲット遺伝子としたIL-8、TNFについては、 PMA濃度依存的な発現量の亢進を確認することができました。