コーヒーブレイク
RNAはどれくらい置くと分解してしまうのか?
■はじめに
新学期シーズン!新しい実験に取り組まれる方も多いのではないでしょうか。
さて、RNAを取り扱う実験においてRNAは不安定なので取り扱いに気を付けて、と言われますが、例えば室温などにRNAを誤って放置してしまった場合、どれくらいの時間で分解してしまうのでしょうか。
今回はあえてRNAを放置して、安定性を評価してみました。
■実験方法
HeLa total RNAを水もしくは0.1×TE Buffer(TE Bufferを水で10倍希釈したもの)で5 ng/μLに希釈し、希釈後 室温(25℃)もしくは70℃で0 min/10 min/30 min/1 h/4 h放置しました。その後、THUNDERBIRD® Probe One-step qRT-PCR Kit [Code No.QRZ-101] を用いてRNA中のβアクチンの増幅を行い、Ct値を比較しました。
RNase free water 4.2μL
2×Reaction Buffer 10 μL
DNA Polymerase 0.5 μL
RT Enzyme Mix 0.5 μL
Forward Primer 1μL(10 pmol)
Reverse Primer 1μL(10 pmol)
TaqMan® probe 0.4μL (4 pmol)
50×ROX Reference dye 0.4 μL
RNA溶液 2 μL
Total Volume 20μL
使用機器:Applied Biosystems® StepOnePlusTMリアルタイムPCRシステム
逆転写反応 50℃ 10 min
↓
初期変性 95℃ 1 min
↓
PCR 変性 95℃ 15 sec → 伸長 60℃ 45 sec (55 cycles)
■結果
増幅曲線の比較(25℃放置 水希釈RNA 0 min(赤)-4 h(青))

増幅曲線の比較(25℃放置 0.1×TE希釈RNA 0 min(赤)-4 h(青))
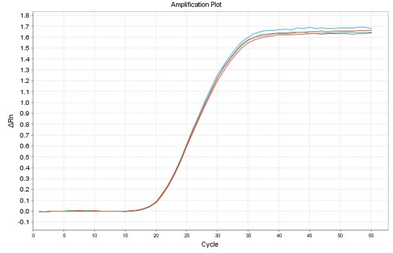
25℃で放置した際のCt値の平均(n = 2)
| 水 | 0.1×TE | |
| 0 min | 22.9 | 22.6 |
| 10 min | 22.7 | 22.6 |
| 30 min | 22.7 | 22.6 |
| 1 h | 22.8 | 22.6 |
| 4 h | 22.7 | 22.6 |
| ΔCt (4h - 0 min ) | -0.2 | 0.0 |
増幅曲線の比較(70℃放置 水希釈RNA 0 min(赤)-4 h(紫))

増幅曲線の比較(70℃放置 0.1×TE希釈RNA 0 min(赤)-4 h(紫))
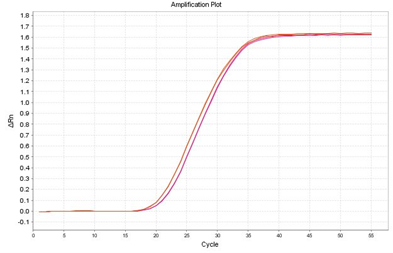
70℃で放置した際のCt値の平均(n = 2)
| 水 | 0.1×TE | |
| 0 min | 22.8 | 22.7 |
| 10 min | 22.5 | 22.2 |
| 30 min | 22.6 | 22.3 |
| 1 h | 23.0 | 22.5 |
| 4 h | 24.7 | 23.4 |
| ΔCt ( 4h - 0 min ) | +1.9 | +0.7 |
室温で4 h置いてもRT-qPCRでは問題ないという結果になりました。一方、70℃の過酷条件ではRNAの分解が確認されました。緩衝能がありEDTAが含まれている0.1×TE Bufferでの希釈の方がRNAの安定性は高い結果でした。
途中で実験を止める必要がある、慣れていない作業で不安…という方は、0.1×TE bufferを使用して希釈するのがおすすめです!
RT-qPCRはRNAの一部を増幅して定量するため、RNA全長の安定性を評価したものではございません。これらの結果は用いるRNAや評価方法によっても異なりますので、あくまで参考としてお楽しみください!
■さいごに
今回使用した製品をご紹介します!

THUNDERBIRD® Probe One-step qRT-PCR Kit
●迅速・高感度
微量なRNAを1-stepで迅速・高感度に検出します。
●配列バイアスの低減
ターゲット配列に左右されることなく、さまざまなRNAを高感度に検出可能です。
* Applied Biosystems® は、Applied Biosystems Inc.の登録商標です。
* StepOnePlusTM は、Applied Biosystems Inc.の商標です。
* TaqMan® は、Roche Diagnostics K.K.の登録商標です。







