コーヒーブレイク
「源流を遡る」 第8回
第8回 運命の選択 <2008年2月>
「なぜ、制限酵素は、『制限』酵素と呼ばれるようになったのでしょう?」などという質問をすると、「それなら授業で習って知っている!」と即答されそうですが、今回は敢えてその原点に遡ってみようかと思っています。お時間のある方のみ、お付き合いください。
<実は、前回の『夢の?アガロースゲル電気泳動法』で参考にした「人工生命(J.チャーファス著)」に触発されました。以下のかなりの部分は、この本を参考にしています>
終戦から7年経った1952年、イリノイ大学のLuriaらは、ある細菌株中で増殖したT2ファージの性質が何らかの要因で変化し、通常感染する菌株に感染できなくなるという不思議な現象を見出しました。この現象は、「宿主支配の制限(restriction)」と呼ばれるようになります。Luriaは、ある種の細菌には、ファージなどの異物DNAを認識して分解するような防御機構が備わっているのではないかと考えました。
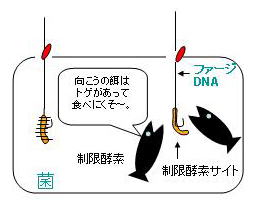 1962年には、ジュネーブ大学のArberも、大腸菌K12株で増殖したλファージがKP1株ではほとんど増殖できないが、KP1株で生じたごく少数のプラークから分離されたλファージはK12にもKP1株にも同じく感染できることを見出しました。アーバーはこれらの現象はDNAが何らかの修飾を受けることによっており、修飾されたDNAを持つファージは感染性を獲得するのではないかと考えました。
1962年には、ジュネーブ大学のArberも、大腸菌K12株で増殖したλファージがKP1株ではほとんど増殖できないが、KP1株で生じたごく少数のプラークから分離されたλファージはK12にもKP1株にも同じく感染できることを見出しました。アーバーはこれらの現象はDNAが何らかの修飾を受けることによっており、修飾されたDNAを持つファージは感染性を獲得するのではないかと考えました。
既にお分かりと思いますが、Luriaらによって予言された宿主支配の『制限』に関わる酵素こそ『制限』酵素であり、Arberらによって提唱された修飾はDNAのメチル化です。しかし、この段階ではそれらがどういう機構(物質)によって担われているかは不明でした。
1968年、ケンブリッジ大学のYuanらは、DNAを特異的に分解する『制限』酵素が大腸菌K12株にあると仮定し、精製を試みました。制限酵素活性の測定には、切断をうけるはずの大腸菌(C600.4株[rk-, mk-])から調製したλDNAと、切断を受けないはずの大腸菌株(C600株)から調製したλDNAを、それぞれラジオアイソトープラベルし、酵素を作用させた後、超遠心での易動度の違いにより切断の有無を検出する方法を用いました。この方法は前回も紹介しましたが、結構大変だったようです。
結果、K121株の破砕液には、C株由来のDNAのみを特異的に分解する、明らかな「制限」酵素活性が検出されました。
また、精製を進めていく中で、彼らは、この酵素が透析により完全に活性を失ってしまうという不思議な性質があることを見出します。この酵素の活性にはSAM(S-アデノシルメチオニン)とATPなどの低分子成分が必要でした(厳密にはマグネシウムも要求します)。最終的にYuanらはこの酵素の精製に成功し、1968年にNatureにその成果を発表しました。
| M. Meselson and R. Yuan, DNA Restriction Enzyme from E. coli. Nature, 217: 1110-1114 (1968) |
しかし残念なことに、その後、この酵素の作用機構は長い間解明されることはありませんでした。なぜなら、この酵素は認識サイトからは離れた場所をランダムに切断するタイプの制限酵素だったからです。この機構が明らかとなるのは1970年代の後半になってからであり、Yuanらの酵素は、認識部位から1,000bp以上も離れた部位を切断することが分かりました。(これらの制限酵素は、今日、I型制限酵素と呼ばれています)
余談ですが、この論文では、現在も使用されているDEAEやP-cellなどのクロマト担体が、既に精製に用いられています。
その後の、制限酵素の発展は劇的です。Yuanらの論文から2年経った1970年、Smithらにより2報の論文が続けざまに発表されました。彼らは、Hemophilus influenzae Rd.という菌から別の種類の制限酵素を精製し、しかもその切断サイトまで明らかにしてしまいました。また、この酵素はYuanらの酵素と大きく異なり、SAMもATPも要求しませんでした(マグネシウムのみ要求)。
| H. O. Smith and K. W. Wilcox, A Restriction Enzyme from Haemophilus influenzae. I. Purification and General Properties J. Mol. Biol. 51: 379-391 (1970) |
この酵素こそ、皆さんが日々使用しているII型と呼ばれる制限酵素でした。II型の制限酵素は、特定の認識配列と切断配列を有する酵素で、マグネシウムのみを要求するのが特徴です。この酵素は、Haemophilus influenzae Rd.から分離されたことから、後にHindII (注1)と命名されました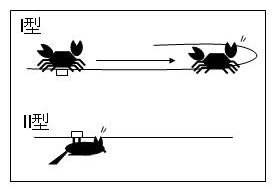 (この論文の中では、”endonucelase R”と呼ばれています)。
(この論文の中では、”endonucelase R”と呼ばれています)。
この論文では、この酵素の、活性測定には粘度計が使われました。なぜ粘度計かというと、DNAは高分子ポリマーであり、その粘度はDNAが分解を受けることにより粘度が低下するからです。実際に、彼らはH.influenzaeのDNAの粘度は低下させずに、p22ファージのDNAの粘度だけを低下させる活性を定量的に測定しました。この方法は超遠心法よりもかなり簡便だったようです。
また、彼らはこの論文の中で、NaCl濃度の制限酵素活性に及ぼす影響や、DNAの切断面のどちら側(5’側or3’側)にリン酸基が残っているか、などについても細かい実験を行っています。ここでの、Smithらの経験は、現在でも、我々が制限酵素を用いる時の注意事項であることは、いかに彼らの研究が的を射たものであったかを物語っています。
その5ヶ月後に提出された2報目の論文では、この酵素の切断配列が「GTPy|PuAC(Py=C,T, Pu=A,G)」であることが報告されています。当時、当然ながらシーケンス法は開発されていませんので、彼らは様々な知恵を絞ってその配列を決定しなくてはなりませんでした。彼らが切断配列を決定した方法は当時明らかになっていた方法を駆使した感動すべき方法でした(今回、この方法に関しては割愛させていただきます。この方法に関しては、次回にでもご紹介しましょうか?)。
ともかく、この発表以降、様々な菌から認識サイトと切断サイトを持つII型制限酵素が多数存在す次々と報告され、分子生物学実験に欠くことのできない道具の一つとなりました。Smithらはその功績により1978年にノーベル賞を受賞しました(注2)。
最後に、今回、この歴史を調べてみて、I型制限酵素を発見したYuanとII型制限酵素を発見したSmithの違いは、何だったのだろうかということを考えさせられました。私が言うのも大変失礼な話しですが、両者の研究は非の打ち所の無いほどすばらしい研究です。何度も言うように歴史には“if”はありませんが、YuanがHemophilus influenzae Rd.にSmithが大腸菌K12株に着目していても全くおかしくなかったかも知れません。ノーベル賞の受賞にだけ絞って考えると、両者の運命を大きく分けたものは、最初の研究対象の選択だったのかも知れません。
また、何も解明されていない当時、扱いの簡単な大腸菌を選択したYuanらは、順当だったともいえます。しかし、脳・心臓浸出物を含むような特殊な培地でしか培養できないような病原菌(注3)の方に『財宝』は隠されていました。
とにかく、研究テーマや材料の選択は、努力や先見の明だけでは如何ともしがたい『運命の選択』となることも多いようです。皆さんの卒論や修論、D論のテーマはいかがでしょうか?
注1)HindIIIではありません。また、HindIIの認識サイトと切断サイトはHincIIと全く同じです。
注2)1978年12月、Smith、Arber、及びNathansは、制限酵素の発見と分子遺伝学への応用 に対してノーベル生理学・医学賞を受賞しました。
注3)1800年代のインフルエンザの大流行の際に、原因菌として分離された細菌ですが、インフルエンザとの関連性は否定されています。
(T.K.)
2008年2月掲載
 Indexに戻る
Indexに戻る







