実施例
Can Get Signal immunostain 実施例1 Schneider 2 (S2)のalpha-tubulin染色における従来法との比較実験(免疫染色)
【データご提供】京都大学 研究員様
|
【実験方法】 (2)サンプル調製法:Tissue Cultured Cells (3)ブロッキング、内因性ペルオキシダーゼ活性阻止 (4)抗体 <1次抗体の検出方法> <2次抗体,検出用キット> (5)発色方法・検出方法 |
【結果・コメント】
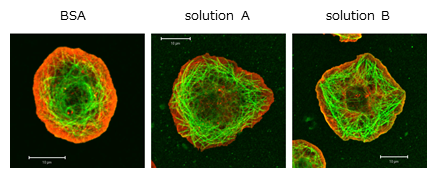
蛍光退色防止剤 (FluorSave Reagent[CALBIOCHEM #345789]) を用いてサンプルをマウントし、共焦点顕微鏡観察 (ZEISS LSM 510) を行いました。添付した画像は、共焦点顕微鏡の画像取得条件(gainやレーザー強度など)は、全く同条件で行い、また、得られた画像のコントラスト等の画像処理は行っていません。
従来法でも、細胞内のチューブリン構造は可視化できていましたが、Can Get Signal® immunostainを使用した場合は、顕著なシグナル増強が認められ、従来法では、ややdiffuseであったチューブリン束のシグナルが、鮮明に検出されました。
また、細胞内のバックグラウンドと思われるシグナルが減少傾向にありました。
Solution A、Solution Bのどちらも、シグナルの増強が認められましたが、Solution Bの方が若干強い印象を受けました。Phalloidinで同時にアクチン骨格を可視化したところ、抗原抗体反応以外の反応には顕著な影響は見られませんでした。
ただ、Can Get Signal® immunostainを使用した場合、細胞が存在しない部分(Concanavalin Aでコートしたガラスディッシュ上)に、非特異的なシグナルが多くみられた点が若干気になりましたが、この件を考慮しても、全体的にはCan Get Signal® immunostainは、十分にシグナルを増強させることができると思いました。ちなみに、この非特異的なシグナルが、洗浄過程をより十分にすることで減少するかどうかについては未確認です。
今回使用した抗体は、ごく一般的な抗体でしたが、シグナル検出感度が低いものでは、より一層効果が期待できるのではないかと思います。
 Can Get Signal®immunostain製品ページ
Can Get Signal®immunostain製品ページ
 実施例一覧ページ
実施例一覧ページ







